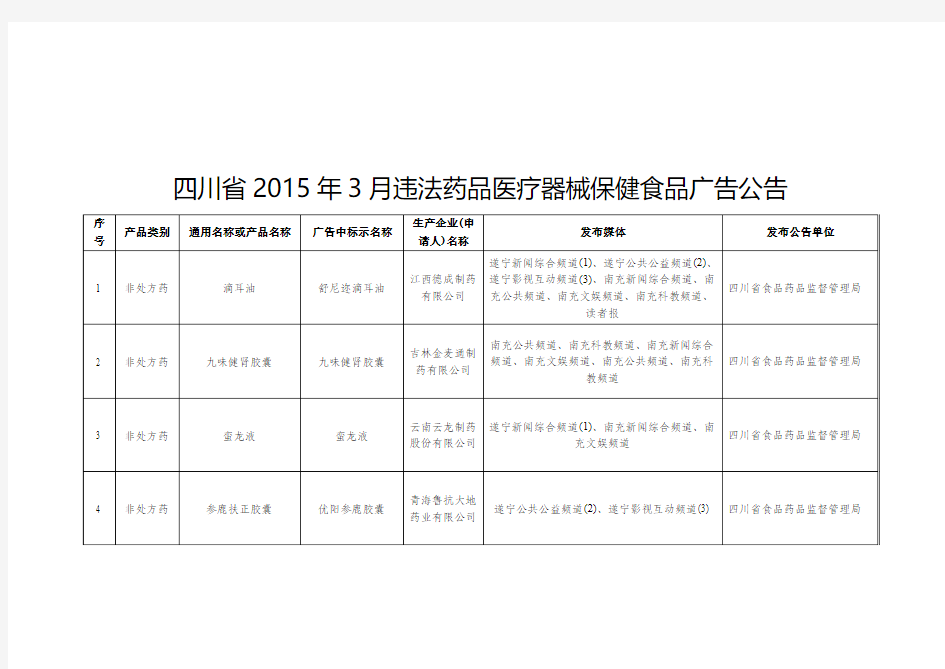
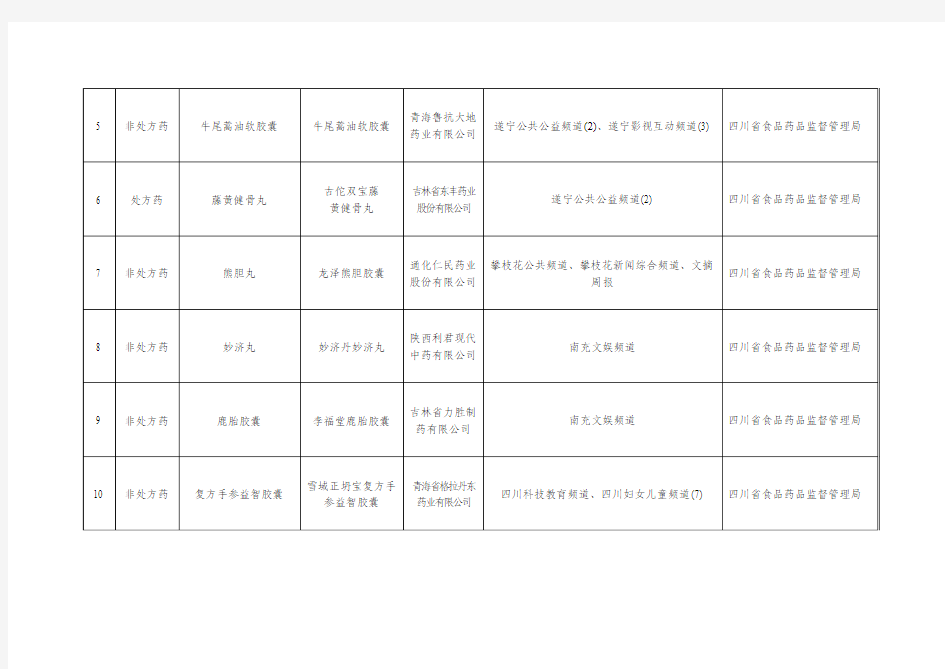
四川省2015年3月违法药品医疗器械保健食品广告公告
保健品营销策划方案 篇一 近年来老年保健品市场空间巨大,随着生活水平的提高,人们的保健意识越来越强烈,20xx年国内医药保健品销售额为1508亿元,20xx年为1780亿元,比20xx年增长了11.4%,是1980年70亿元的25倍,平均年增长率13%。 20xx年达20xx亿元左右, 预计2005年可达到2500亿元, 20xx年将达到4300亿元, 2020年将达到13000亿元!参考数字 (据7月3日出版的《经济日报》所援引的资料,全球保健食品已占整个食品销售的5%,达上千亿美元,而且每年都以相当速度增长。美国目前的保健食品销售额达750亿美元,占食品销售额的1/3;日本近两年的保健品销售额为15000亿日元,年产保健品3000多种;欧洲的保健食品也有20xx余种,销售额以每年17%的速度递增。我国自古就有药食同源的养生文化,用老百姓的话说,就是“药补不如食补”。作为一个亟须培育的行业,保健品市场的需求潜力之大实在诱人。20xx年我国保健食品年销售额达到500亿元,*部门预计到20xx 年将达到1000亿元。) 1、市场前景:2005年底我国60岁及以上老年人口总数为1.44亿,到20xx年将达到1.73亿,到2050年,60岁及以上老年人口总
数为4.3亿。这些庞大的数字告诉我们老年人保健品市场将会成为商家必争之地。前景广阔,市场空间巨大。 2、市场概述:目前我国老年保健品市场相对混乱尚不成熟,各领风*三五年,很少有长胜的品牌,多以概念炒作为主,通过广告忽悠消费者,对消费研究尚不到位,根本不了解消费的真实想法与所需要什么? 3、环境法规:广告法在保健品上体现不明显,保健品广告虚假、胡跨太大,明明只是普通的保健品,在商家广告中径成为治疗糖尿并心脑血管病的新疗法,而我国的一些媒体却助长了虚假广告的盛行,只要给钱就给上,这样更加纵容老年保健品的混乱。 4、国家环境:目前国家对房地产的控制,国八条、国六条的相继出台可以看出保健品的混乱格局将不会维持太久,保健品广告宣传必将受到国家的严格限制。必将会出台一系列的政 产品分析(SWOT) 优势: 1)***为中药保健,现今消费者知道西药治标,中药治本,而对糖尿并心脑血管等终身顽疾的病症来说,中药才是灵药,例如:如果感冒了你决不会选择中药,因为没有必要,但是如果你的了很难治愈的病,无疑你会选择中药。 2)茶剂,***得主要成分为茶中精华:茶多酚、茶多糖、茶儿茶素等。这些成分是消费者熟知的,对病症有疗效。茶,文化悠久,容易让消费者信赖,不会产生抵触心理。
国家药品质量管理(GSP)制度范本 质量管理人员的任命 x x x x药店文件 经本企业研究决定,从发文之日起设立本企业质量管理人员,具体负责本企业的质量管理工作,在企业内部对药品质量进行裁决,对本企业经营药品的质量具有一票否决权,提出并监督实施采购合同的质量条款,规范本企业台帐、原始记录,接受企业内部关于质量技术问题的咨询。同时,任命XX为质量负责人。 质量负责人的职能是: 一、负责贯彻执行国家有关药品质量管理的法律、法规和行政规章。包括: 1、组织学习国家有关药品质量管理的法律、法规和行政规章。 2、宣传、贯彻、执行国家有关药品质量管理的法律、法规和行政规章。 3、熟练掌握药品法律、法规等基本知识。 4、指导本企业在药品的购进、验收、储存与养护中严格按药品的有关法律、法规办事。 二、负责起草、编制本企业药品质量管理制度,并指导、督促制度的执行。包括药品质量管理制度的起草和操作规程的制定。 三、负责首营企业的质量审核。 四、负责首营品种的质量审核。 五、负责建立企业所经营品种包含质量标准等内容的质量档案。
六、负责药品质量的查询和药品质量事故或质量投诉的调查、处理及报告。 七、负责药品的验收管理。 八、负责指导和监督药品保管、养护和运输中的质量工作。 九、负责质量不合格药品的审核,对不合格药品的处理过程实施监督。包括对不合格药品的确认、处理、报损和监督销毁。 十、负责收集和分析药品质量信息。包括本企业的外部信息和内部信息的收集、分析和报告。 十一、负责协助开展对本企业职工药品质量管理方面的教育或培训。 药品购进管理制度 XXXX药店文件 一、药品进货必须严格执行《药品管理法》、《产品质量法》、《合同法》及《药品经营质量管理规范》等有关法律法规,依法购进。 二、进货人员须经专业和有关药品法律法规培训,考试合格,持证上岗。 三、购进药品以质量为前提,从具有合法证照的供货单位进货。 四、购进药品要有合法票据,并依据原始票据建立购
对照药品(参比制剂)一次性进口公告解读 对照药品一次性进口公告有以下特点: 1.公告指出:受理审查及审批权力委托给各省局,极大程度简化了程序,节约时间; 2.公告规定了受理时限5个工作日,审查时限20个工作日。 3.进口药品批件有效期延长至12个月。 4.申报资料不再要求提供对照药品的质量标准和出厂检验报告书, 5.需向预进口口岸食品药品监督管理局进行备案。 进口备案要求 拟进口的对照药品应从《进口药品批件》载明的药品进口口岸进口。进口备案按照以下程序办理: (一)申请人向口岸食品药品监督管理局提出申请办理《进口通关单》,并同时提供以下资料: 1.所进口药品的《进口药品批件》; 2.申请人机构合法登记证明文件复印件(如营业执照、组织机构代码证等)。属于委托申请的,另须提供委托人的合法登记证明文件复印件及委托证明文件; 3.原产地证明复印件; 4.货物合同复印件; 5.装箱单、提运单和货运发票复印件; 6.药品说明书及包装、标签式样(原料药和制剂中间体除外); 7.经其他国家或者地区转口的进口药品,需要同时提交从原产地到各转口地的全部购货合同、装箱单、提运单和货运发票等。 上述各类复印件应当加盖申请人公章。 (二)口岸食品药品监督管理局应按照《药品进口管理办法》的相关规定办理对照药品的进口备案(进口单位取得《药品经营许可证》(生产企业应当取得《药品生产许可证》)和《企业法人营业执照》)。审查工作中,加强对原产地证明文件、购货合同以及发票等文件的审核,确认所进口对照药品的真实产地。 (三)口岸食品药品监督管理局审查全部资料无误后,准予进口备案,发出《进口药品通关单》。 6.明确说明:研究用对照药品的一次性进口申请,可不要求进行口岸检验的规定。 7.临床试验对照品检验规定放宽为申请人可自行检验,也可委托药品检验所进行委托检验。 8.明确规定临床试验对照药品的检验标准选择:(1)生产厂家的质量标准;(2)《中华人民共和国药典》2015年版中收载对的标准;(3)申请人自拟标准,且符合《中华人民共和国药典》2015年版的通用要求。 9.增加了麻醉药品、精神药品、临床试验用生物制品的对照药品不适用本公告的规定。 1
方案编号:YT-FS-7461-49 保健品营销策划方案(完 整版) Develop Detailed Rules Based On Expected Needs And Issues. And Make A Written Plan For The Links To Be Carried Out T o Ensure The Smooth Implementation Of The Scheme. 深思远虑目营心匠 Think Far And See, Work Hard At Heart
保健品营销策划方案(完整版) 备注:该方案书文本主要根据预期的需求和问题为中心,制定具体实施细则,步骤。并对将要进行的环节进行书面的计划,以对每个步骤详细分析,确保方案的顺利执行。文档可根据实际情况进行修改和使用。 保健(功能)食品是食品的一个种类,具有一般食 品的共性,能调节人体的机能,适用于特定人群食用, 但不以治疗疾病为目的。所以在产品的宣传上,也不 能出现有效率、成功率等相关的词语。现在,就来看 看以下两篇关于保健品营销策划的方案吧! 保健品营销策划的六大核心要素 在营销界流传着这样一句话"看国内的营销先看 保健品的营销",这句话一点也不假,同时也可以看出 保健品行业是一个竞争十分激烈的行业,也最能体现 出营销的深邃。正因为如此,正本医药认为这个行业 没有真正意义上的老大,即使是像史玉柱这样的巨人 级营销策划大师也不敢说我再上一个新产品就一定会 火,但也不是说没规律可循,谁掌握了保健品营销策
划的规律并加以灵活运用,谁就能创造奇迹、演绎神话。 那么,保健品营销策划的规律是什么呢?风火锐意认为对于保健品的营销策划有六大核心要素,作为一个专业策划人员来讲必需掌握握它。 产品名设计:取个过耳不忘的好名字 保健品的竞争越来越激烈,同质化日趋严重。媒体成本日益高涨,广告投入风险巨大。设计一个好名字,让消费者耳目一新,过耳能详。这样不仅易于传播,同时还能帮企业省下一大笔广告费。如"伊人静",一看名字就知道它的功效是妇科护理产品,而且它又于台湾歌星伊能静属谐音,搭乘名人快车,可制造新闻自行炒作,从传播上讲朗朗上口,而且娓婉含蓄地体现了产品的特色,但也有借谐音不雅的例子,如一个止泻的产品叫" 泻停封",把止泻药与明星连在一起多少让人觉得有点别忸。 还有减肥名药"曲美",一听名字就能让人联想到一个 "胸挺、腰细、臀翘"的曲线美人,加上形象代
药品质量公告 (总第67期) 国家食品药品监督管理局发布 2006年10月 根据2006年全国药品抽验计划,国家食品药品监督管理局组织有关单位在全国范围内对相关品种进行了药品质量抽查检验,在抽验中发现18个批次的药品为假冒药品,涉及1家医疗机构、17家药品经营企业(见附表),现予以公告。 对公告中的假冒药品立即停止销售和使用,涉及经营、使用假冒药品的经营企业和医疗机构所在地的药品监督管理部门要认真追查假药的来源,依法从严查处。 附表:假冒药品名单
药品质量公告 (总第68期) 国家食品药品监督管理局发布 2007年3月
进行了药品监督抽验,本期公告内容为在流通和使用单位对15个品种的不同剂型进行抽查检验的结果。具体为: 阿司匹林(肠溶片、胶囊、泡腾片、维生素C分散片):41家生产企业的200批次为合格药品,5家生产企业的9个批次为不合格药品; 氨咖黄敏(胶囊、颗粒、片):44家生产企业的205批次为合格药品,1家生产企业的1个批次为不合格药品; 布洛芬缓释胶囊:34家生产企业的182批次为合格药品,1家生产企业的1个批次为不合格药品; 复方氨酚烷胺(片、分散片):149家生产企业的746批次为合格药品,5家生产企业的5个批次为不合格药品; 复方对乙酰氨基酚片:52家生产企业的165批次为合格药品,4家生产企业的5个批次为不合格药品; 交沙霉素片:13家生产企业的129批次为合格药品,1家生产企业的1个批次为不合格药品; 青霉素V钾(片、分散片):36家生产企业的394批次为合格药品,5家生产企业的27个批次为不合格药品; 维生素B12片:15家生产企业的314批次为合格药品,1家生产企业的1个批次为不合格药品; 维生素E烟酸酯(胶囊、胶丸):19家生产企业的53批次为合格药品,1家生产企业的1个批次为不合格药品; 盐酸利多卡因注射液、蚓激酶(胶囊、片)、甲硫氨酸片、胰激肽原酶肠溶片、左旋多巴注射液和对乙酰氨基酚颗粒6个品种抽验结果为符合规定。 药品质量公告 2007年度第一期 (总第69期) 国家食品药品监督管理局发布 2007年5月
国家食品药品监督管理局关于发布2003年第二季度国家药品 质量公告的通知 【法规类别】药品管理 【发文字号】国食药监市[2003]177号 【发布部门】国家食品药品监督管理局(原国家药品监督管理局)(已撤销) 【发布日期】2003.07.23 【实施日期】2003.07.23 【时效性】现行有效 【效力级别】XE0303 国家食品药品监督管理局关于发布2003年第二季度国家药品质量公告的通知 (国食药监市[2003]177号) 各省、自治区、直辖市药品监督管理局,解放军总后卫生部,武警总部卫生部,中国药品生物制品检定所: 根据2003年国家药品抽验计划,中国药品生物制品检定所组织各省级药品检验所在全国范围内对药品经营企业、医疗机构及中药材专业市场进行了抽查检验(结果详见附件1:药品质量公告,总第56期)。现将抽验结果予以公告并将有关事项通知如下: 一、2003年第二季度完成国家计划抽验概况 中国药品生物制品检定所组织省级药品检验所完成了对阿替洛尔片等20种化学药品在经营企业、医疗机构的统一抽验工作,共抽验2694个批次。其中,合格批次为2637批
次,抽验合格率(批次)为97.9%。 中国药品生物制品检定所组织省级药品检验所,完成了对17家中药材专业市场的监督检查抽验工作。共抽取样品2259件,涉及药材品种86种。其中,合格件次为1616件,不合格件次为643件。其中重点抽验了常用中药材丹参、金银花、山茱萸、防已、菟丝子、黄芩、黄柏、厚朴、黄连、黄芪、龙胆、南五味子、乌梅、栀子、枳壳等15个品种。共抽验了1598件样品,合格件次为1079件,不合格件次为519件。 从抽验结果看,流通领域化学药品的质量较为稳定。中药材专业市场的药材质量仍存在严重问题,市场管理仍存在混乱现象。这表明当前迫切需要对中药材专业市场进行整顿和规范。
保健品网络营销策划方案 篇一:汤臣倍健保健食品的网络营销策划方案 汤臣倍健保健食品的网络营销策划方案 第一部分 行业及市场情况 市场分析 在当今世界,保健食品研制开发使每个发达国家的热点之一,世界卫生组织的一项调查显示,世界人口有15%处于健康状态,15%处于不健康状态,其余70%处于亚健康状态,亚健康状态的人群成为保健品消费的主力军。保健食品具有特定的保健功能,人们会根据自己的情况选择适合自己的食品。节约资源,保护环境,保护我们共有的家园是21世纪的主题。因此,无污染、不含防腐剂及色素的纯天然保健食品也会成
为人们的选择。随着亚健康人群的增加和人口日益老龄化,保健食品市场将呈现蓬勃发展的局面。 图1 在网民规模飞速发展的同时,我国网络用户的结构却在不断优化。数据显示,我国宽带普及率继续提高,宽带网民规模达到亿人,较2008年增长了7600万。09年与08年相比,中国网民年龄结构更为优化。30岁以上年龄段人群占比攀升,整体占到网民的%。这部分人群更为成熟,消费能力较强,是互联网经济发展的重要用户群。月收入在2000元以上的网民群体占比也在增大,目前月收入在2000元以上的网民占比达到了三分之一。 图2 有44%的消费者会从网络上去寻找保健品的相关信息,而且已经有17%的消费者会直接从网络进行购买。这说明消费者在选择和购买保健品的时候,已经对网络产生了一定程度地依赖。
图3 从上面的表中我们可以看到食品保健类产品在网购中所占的比重很小,所以未来的保健品在网上销售的空间很广阔。 图4 从网上购物用户的属性特征表可以看出网上购物的用户的收入水平处于中低收入,而且网上购物的用户的文化程度相对较高,年龄主要集中在中青年阶段,非常适合我公司现阶段的情况,我们产品就是定位在中高档阶层,所以我们的产品开展网上销售有很大的竞争优势。 第二部分 产品 产品分析 一、产品优势 首先,营养与健康类食品以其功能性与独特性将越来越受到消费者青睐。第二,产品独特的外观设计。 第三,先进的销售渠道。与其它大
药品质量信息收集制度 1、为建立质量保证体系,不断提高药品质量,根据《中华人民共和国药品管理法》特制定药品质量信息收集制度,以确保购进、使用、贮存过程中的药品质量信息反馈顺畅。 2、质量管理小组为质量信息中心,负责质量信息的传递、汇总、处理。 3、质量信息包括以下内容: (1)国家最新颁布的药品管理法律、法规及行政规章;国家新颁布的药品标准及其他技术性文件;国家发布的药品质量公告及当地有关部门发布的管理规定等。 (2)供应商质量保证能力及所供药品的质量情况。 (3)医院与药品质量有关的数据、资料、记录、报表、文件等,包括药品质量、服务质量、工作质量各个方面以及在药品的质量验收、养护、保管、出库复核以及质量检查中发现的有关质量信息。 (4)药品监督管理部门检查发现的与本院相关的质量信息。 (5)质量查询、质量反映、质量投诉以及质量事故中收集的质量信息。 4、质量信息的收集方式: (1)质量政策方面的各种信息:由质量管理人员通过各级药品监督管理文件、通知、专业报刊、媒体及互联网收集; (2)医院内部质量信息:由各有关岗位通过各种报表、会议、信息传递反馈单、谈话记录、查询记录、建议等方法收集; (3)质量投诉和质量事故的质量信息:通过设置患者意见簿、患者调查访问等方式收集患者对药品质量、服务质量的意见。 5、质量信息的收集应准确、及时、适用,建立质量信息档案,做好相关记录。 6、质量管理人员应对质量信息进行评估,并依据质量信息的重要程度,进行分类,并按类别交予相关人员进行存档和处理。 7、建立完善的质量信息反馈系统,对异常、突发的质量信息要以书面形式及时向有关部门反馈,确保质量信息的及时畅通传递和准确有效利用。 8、各部门应相互协调、配合,如因工作失误造成质量信息未按要求及时、准确反馈,连续出现两次者,将在季度质量考核中处罚。 1
医疗药品广告中应注意避免出现的问题 文案编辑室姜丽玲 长期以来,医疗药品广告的审核一直是让文案编辑人员头痛的事。在这类广告中,违法违规的地方太多。如果严格按照标准审核,客服、业务人员认为我们在给他们填麻烦;广告发布商会认为改动后的广告失去了吸引消费者或者患者的地方,广告也就失去了意义,他们以如果改动太大便要撤版相要挟。 如何把握广告特别是医疗药品广告的审核标准,令文案编辑人员费尽了心思。为最大限度保证广告的按时上版,文案编辑人员会对一些太明显的违法违规的地方进行变通,但即使这样,也难以保证见报的广告不给单位带来负面影响。 今年我们市要申报全国文明城市,建设一个温馨和谐、文明繁荣的家园成为我们大家共同的心愿。创建文明城市,需要我们大家共同的支持与努力。我们所在的单位是我们赖以生存的基础,保持基业稳固,更需要我们每一个工作人员的理解与支持。因此,净化医疗药品广告市场,规范医疗药品广告的发布不仅仅是广告文案编辑人员的职责,这也应该成为我们每个报业广告人甚或是广告发布商应该遵循的最基本的守则。 根据《中华人民共和国广告法》及《中华人民共和国药品管理法》的规定,以下问题是所有医疗药品广告中应该注意的问题。 首先,发布药品广告的广告商必须执有发布的医疗药品的《药品生产许可证》、《药品经营许可证》或者《医疗机构制剂许可证》。 其次,药品广告必须要有批准文号;未取得药品广告批准文号的,不得以任何形式发布任何广告。有药品专利号的,必须标明药品专利号;没取得专利权的,不得谎称取得专利权。 再次,药品广告的内容必须真实、合法,以国务院药品监督管理部门批准的说明书为准,不得含有虚假的内容。非药品广告不得有涉及药品的宣传。 广告发布必须遵守九不准则: (一)使用中华人民共和国国旗、国徽、国歌; (二)使用国家机关和国家机关工作人员的名义; (三)使用国家级、最高级、最佳等用语; (四)妨碍社会安定和危害人身、财产安全,损害社会公共利益; (五)妨碍社会公共秩序和违背社会良好风尚; (六)含有淫秽、迷信、恐怖、暴力、丑恶的内容; (七)含有民族、种族、宗教、性别歧视的内容; (八)妨碍环境和自然资源保护; (九)法律、行政法规规定禁止的其他情形。 具体在药品、医疗器械广告中不得出现下列内容: (一)含有不科学的表示功效的断言或者保证的,如根治、不复发、彻底治愈等;不科学的用语或表示,如“最新技术”、“最高科学”、“最先进制法”、“顶级”、“唯一”等。 (二)说明治愈率或者有效率的,如有效率达99%。治愈率达96%以上;含有“安全无副作用”、“毒副作用小”等内容的,含有明示或暗示中药为“天然”药品,因而安全性有保证等内容的;违反科学规律,明示或暗示包治百病适应所有
《中国药典》2015年版实施公告 有关问题的解读(一) 1. 问:国家食品药品监督管理总局关于实施《中华人民共和国 药典》2015年版(以下简称“2015年版药典”)有关事宜的公告(以下简称“公告”)(2015年第105号)中规定,为符合2015年版药典而需进行补充申请的,应在2015年 12月1日前进行申报,2015年12月1日后是否仍可提交相应补充申请? 答:对2015年版药典发布前已上市药品,生产企业应在2015年12月1日前完成原标准与新版药典相关要求的研究和比对,并应按公告要求进行相应的备案或补充申报。2015年12月1日以后仍可以提交相应补充申请。 2. 问:企业的注册标准已经对2010年版药典相关品种进行评估 的,且2010年版与2015年版药典品种质量标准和检测方法无变化的,是否需要重新对产品进行评估? 答:虽然品种正文内容与2015年版药典品种规定无变化,但由于2015年版药典通用性要求,包括凡例、通则、制剂通则以及通用性检验方法等进行了全面的增修订,因此,生产企业仍需针对2015年版药典通用性要求方面对本产品进行相应的评估。 3. 问:关于药品执行标准的表述方式的问题
答:对于注册标准不低于《中国药典》项目的制品,执行注册标准,其执行标准表示方式为:“执行药品注册标准且符合《中国药典》2015年版要求”。 4. 问:对于进口药品生产企业,能否使用注册代理公司出具的 说明信来代替国外的声明信,进行备案或补充申请的申报?答:原则上注册代理公司应出具持证商的声明信。如使用说明信代替国外的声明信,应同时提供进口药品生产企业出具的委托注册代理公司办理该事项的委托书。 5. 问:国家食药总局2015年第67号公告中规定,2015年版药 典自2015年12月1日起实施”。如何界定产品的执行日期?答:按是历版药典执行惯例要求,自2015年12月1日起生产或进口的药品应符合2015年版药典的相关规定。 6. 问:按照实施公告要求提出备案或补充申请的品种,审评审 批期间是否仍可执行原标准,期间若有进口再注册申请的是否可按原注册标准核发新证。 答:申请人应按105号实施公告第五款规定执行。出现补充申请与再注册申请交叉情形者,建议补充申请与进口再注册合并审评,如2015年12月1日起前已提交补充申请,可在补充申请期间执行原标准的要求。 7. 问:制剂中间体是否也需要按照制剂的药典标准进行提高?
在当今世界,保健食品研制开发使每个发达国家的热点之一,保健食品具有特定的保健功能,人们会根据自己的情况选择适合自己的食品。节约资源,保护环境,保护我们共有的家园是21世纪的主题。因此,无污染、不含防腐剂及色素的纯天然保健食品也会成为人们的选择。随着亚健康人群的增加和人口日益老龄化,保健食品市场将呈现蓬勃发展的局面,汤臣倍健行军其中,市场如何,新形势营销该怎么走? 一、企业概况 (一)公司简介 汤臣倍健创立于1995年10月,2002年系统地将膳食营养补充剂引入中国非直销领域,并迅速成长为中国膳食营养补充剂的领导品牌和标杆企业,也是中国保健行业第一家AAA信用等级企业。 (二)品牌介绍 汤臣倍健原名是倍健,上市以后更名为汤臣倍健,诞生于美国,叶酸、蛋白质粉、胶原蛋白等十大品牌之一,为国家保护商标,中国营养补充剂市场的零售终端领先品牌,中国膳食营养产业优秀企业,中国最具潜力上市公司之一,是中国保健行业AAA 信用等级企业。 (三)品牌内涵 “尊重每个人,享受每一天”是汤臣倍健的核心品牌内涵,汤臣倍健坚持“取自全球,健康全家”的品牌思想,相信大自然的力量,在遵循自然规则的前提下,探寻全球天然营养精华。 二、环境分析 (一)宏观环境分析 1.经济环境 随着人们生活水平的提高,养生保健成了人们追求的目标,近几年以来我国保健品行业销售收入年均增速超过40%,反映出行业良好的发展态势。行业经营效益方面,保健品市场销售利润从2010年的51.92亿元增长至2013年的285.94亿元,我国保健品行业发展速度较快,受益于保健品行业生产技术不断提高以及下游需求市场不断扩大,保健品行业在国内和国际市场上发展形势都十分看好 2.社会文化 目前,我国人民生活水平上处于从温饱型向小康型过度阶段,人们从追求吃饱转向吃好、营养。人们的健康观念也发生了较大的变化,从有病看病转向无病防病,防
2014年8月全省部分媒体违法药品广告监测汇总 序号广告中标示名 称 通用名称或产 品名称 广告中标示产品批准 文号 广告中标示广 告批准文号 生产企业名称(或证件持 有者) 发布违法广告 媒体 刊播日期刊播 次数 1 步彤镇痫片镇痫片国药准字Z20063511长春银诺克药业有限公 司 益寿文摘报2014-8-6至152 2 参枝苓口服液参枝苓口服液国药准字Z20120010鲁药广审(文) 第2013090290 号 山东沃华医药科技股份 有限公司 益寿文摘报2014-8-4至132 3 二十五味儿茶 丸 二十五味儿茶 丸 国药准字Z54020041 西藏神猴药业有限责任 公司 益寿文摘报2014-8-6至202 4 二十五味驴血 丸 二十五味驴血 丸 国药准字Z63020186 青药广审(文) 第2014070059 号 青海省格拉丹东药业有 限公司 市场星报2014-8-9至192 新安晚报2014-8-12至121 5 咳喘清片咳喘清片国药准字Z20026826陕西嘉力药业有限公司市场星报2014-8-9至91 6 如一疏风再造 丸 疏风再造丸国药准字Z21021315辽宁华鑫药业有限公司市场星报2014-8-2至21 7 森得日布安神 丸 安神丸国药准字Z63020153 青海省格拉丹东药业有 限公司 益寿文摘报2014-8-4至183 8 唐龙济生橘核 丸 济生橘核丸国药准字Z62021304兰州太宝制药有限公司益寿文摘报2014-8-20至201 9 五苓片五苓片国药准字Z41021370河南宛东药业有限公司益寿文摘报2014-8-4至41
10 银屑灵膏银屑灵国药准字Z21021249沈阳东新药业有限公司新安晚报2014-8-17至171 11 拔云眼膏拨云眼膏国药准字Z53020060滇药广审(文) 第2014030052 号 楚雄老拨云堂药业有限 公司 益寿文摘报2014-8-1至223 12 参蛤平喘胶囊参蛤平喘胶囊国药准字Z20025863青海鲁抗大地药业有限 公司 新安晚报2014-8-3至31 13 参花消渴茶参花消渴茶国药准字B20020426鞍山德善药业有限公司市场星报2014-8-23至231 14 二妙丸二妙丸国药准字Z11020566北京同仁堂制药有限公 司 市场星报2014-8-25至251 15 阜药牌清心沉 香八味丸 清心沉香八味 丸 国药准字Z21020275阜新蒙药有限责任公司益寿文摘报2014-8-6至299 16 复方手参益智 胶囊 复方手参益智 胶囊 国药准字Z20026454 青海省格拉丹东药业有 限公司 益寿文摘报2014-8-6至61 17 火龙金氨糖颗 粒 盐酸氨基葡萄 糖颗粒 国药准字H20090094 冀药广审(文) 第2014020008 号 涿州东乐制药有限公司益寿文摘报2014-8-8至222 18 健民消朦片消朦片国药准字Z20044287陕西健民制药有限公司安徽戏曲广播 (FM99.5 AM801) 2014-8-1至812 19 妙爽益脑胶囊益脑胶囊国药准字Z13020391冀药广审(文) 第2013090225 号 中美华医(河北)制药有限 公司 安徽商报2014-8-2至21 益寿文摘报2014-8-1至11
2015年执业药师考试真题《药事管理与法规》 一、最佳选择题(共 40 题,每题 1 分,每题的备选项中,只有一个最符合题意) 1.关于执业药师资格考试和注册管理的说法,正确的是 A.香港、澳门,台湾居民,按照规定的程序和报名条件,可以报名參加国家执业药师资格考试 B.不在中国就业的外国人,符合规定的学历条件,可以报名参加国家职业药师资格考试 C.执业药师执业单位包括医药院校、科研单位、药品检验机构 D.在香港、澳门注册的药剂师可以直接递交注册申请资料办理执业药师注册 【答案】A 【解析】执业药师注册管理 1.注册机构:各省级食药监部门为本辖区执业药师注册机构。 2.执业范围:药品生产、药品经营、药品使用。机关、院校、科研单位、药品检验机构不予注册。 2.下列内容属于执业药师职责范畴的是 A.指导公众合理使用处方药 B.指导公众合理使用非处方药 C.执行药品不良反应报告制度 D.为无处方患者提供用药处方 【答案】D 【解析】执业药师的职责 (1)执业药师必须遵守职业道德,忠于职守,以对药品质量负责、保证公众用药安全有效为基本准则。(2)执业药师必须严格执行《药品管理法》及国家有关药品研制、生产、经营、使用的各项法规及政策,对违反《药品管理法》及有关法规的行为或决定,有责任提出劝告、制止、拒绝执行并向上级报告。(3)执业药师在执业范围内负责对药品质量监督和管理,参于制定、实施药品质量监督和管理,参与制定、实施药品全面质量管理及对本单位违反规定的处理。 (4)执业药师负责处方的审核及监督调配,提供用药咨询与信息,指导合理用药,开展治疗药物的监测及药品疗效的评价等临床药学工作。 3、关于药品安全风险和药品安全风险管理措施的说法,错误的是 A.药品内在属性决定药品具有不可避免的药品安全风险 B.不合理用药,用药差错是导致药品安全风险的关键因素 C.药品生产企业应担负起药品整个生命周期的安全监测和风险管理工作 D.实施药品安全风险管理的有效措施是要从药品注册环节消除各种药品风险因素 【答案】D 【解析】药品安全风险可分为自然风险和人为风险。存在与药品研制、生产、经营、使用各个环节。 4、关于建立健全覆盖城乡居民的基本医疗卫生制度的基本内容的说法 A.建立健全公共卫生服务体系 B.加快建设多层次医疗保障体系 C.完善以县级公立医院为主的医疗服务体系 D.建立健全以国家基本药物制度为基础的药品供应保障关系
保健食品的营销策划方案 篇一:康之堂保健食品的网络营销策划方案 康之堂保健食品的网络营销策划方案 第一部分 行业及市场情况 市场分析 在当今世界,保健食品研制开发使每个发达国家的热点之一,世界卫生组织的一项调查显示,世界人口有15%处于健康状态,15%处于不健康状态,其余70%处于亚健康状态,亚健康状态的人群成为保健品消费的主力军。保健食品具有特定的保健功能,人们会根据自己的情况选择适合自己的食品。节约资源,保护环境,保护我们共有的家园是21世纪的主题。因此,无污染、不含防腐剂及色素的纯天然保健食品也会成为人们的选择。随着亚健康人群的增加和人口日益老龄化,保健食品市场将呈现蓬勃发展的局面。 图1 在网民规模飞速发展的同时,我国网络用户的结构却在不断优化。数据显示,我国宽带普及率继续提高,宽带网民规模达到亿人,较XX年增长了7600万。09年与08年相比,中国网民年龄结构更为优化。30岁以上年龄段人群占比攀升,整体占到网民的%。这部分人群更为成熟,消费能力
较强,是互联网经济发展的重要用户群。月收入在XX元以上的网民群体占比也在增大,目前月收入在XX元以上的网民占比达到了三分之一。 图2 有44%的消费者会从网络上去寻找保健品的相关信息,而且已经有17%的消费者会直接从网络进行购买。这说明消费者在选择和购买保健品的时候,已经对网络产生了一定程度地依赖。 图3 从上面的表中我们可以看到食品保健类产品在网购中所占的比重很小,所以未来的保健品在网上销售的空间很广阔。 图4 从网上购物用户的属性特征表可以看出网上购物的用户的收入水平处于中低收入,而且网上购物的用户的文化程度相对较高,年龄主要集中在中青年阶段,非常适合我公司现阶段的情况,我们产品就是定位在草根阶层,所以我们的产品开展网上销售有很大的竞争优势。 第二部分 产品 产品分析
国家药品质量公告(2009年第4期,总第80号) 2010年01月14日发布 国家食品药品监督管理局 公告 2010年第2号 国家药品质量公告 (2009年第4期,总第80号) 为加强药品监管,保障公众用药安全,根据2009年国家药品评价抽验计划,国家食品药品监督管理局近期在全国范围内组织对布洛芬制剂、地高辛片、尼群地平片、盐酸溴己新制剂、格列本脲片、双黄连口服制剂、双黄连注射剂、消渴丸、参麦注射液、血塞通注射液、八珍益母制剂、格列吡嗪制剂、硝苯地平制剂、盐酸雷尼替丁胶囊、柴胡注射液、脉络宁注射液、硫酸沙丁胺醇制剂、奥美拉唑制剂18个国家基本药物品种进行了评价抽验。本次抽验的4868批次产品中,有4860批次产品符合标准规定,8批次产品不符合标准规定,结果显示,总体质量状况良好。现将抽验结果公告如下: 一、布洛芬制剂(片、胶囊、缓释片)
全国共有498个药品批准文号,368个生产企业。本次在流通领域抽样350批,涉及47个生产企业,经陕西省食品药品检验所检验,全部符合标准规定。 二、地高辛片 全国共有12个药品批准文号,3个生产企业。本次在流通领域抽样281批,涉及3个生产企业,经福建省药品检验所检验,全部符合标准规定。 三、尼群地平片 全国共有227个药品批准文号,191个生产企业。本次在流通领域抽样337批,涉及38个生产企业,经内蒙古自治区食品药品检验所检验,全部符合标准规定。 四、盐酸溴己新制剂(片、注射液) 全国共有50个药品批准文号,50个生产企业。本次在流通领域抽样198批,涉及10个生产企业,经北京市药品检验所检验,全部符合标准规定。 五、格列本脲片 全国共有85个药品批准文号,85个生产企业。本次在流通领域抽样298批,涉及16个生产企业,经贵州省食品药品检验所检验,全部符合标准规定。 六、双黄连口服制剂(片、颗粒、口服液) 全国共有27个药品批准文号,25个生产企业。本次在流通领域抽样325批,涉及21个生产企业,经黑龙江省药品检验所检验,全部符合标准规定。 七、双黄连注射剂(注射用双黄连〔冻干〕、双黄连注射液、粉针剂)
1.问:国家食品药品监督管理总局关于实施《中华人民共和国药典》2015年版(以下简称“2015年版药典”)有关事宜的公告(以下简称“公告”)(2015年第105号)中规定,为符合2015年版药典而需进行补充申请的,应在2015年12月1日前进行申报,2015年12月1日后是否仍可提交相应补充申请? 答:对2015年版药典发布前已上市药品,生产企业应在2015年12月1日前完成原标准与新版药典相关要求的研究和比对,并应按公告要求进行相应的备案或补充申报。2015年12月1日以后仍可以提交相应补充申请。 2.问:企业的注册标准已经对2010年版药典相关品种进行评估的,且2010年版与2015年版药典品种质量标准和检测方法无变化的,是否需要重新对产品进行评估? 答:虽然品种正文内容与2015年版药典品种规定无变化,但由于2015年版药典通用性要求,包括凡例、通则、制剂通则以及通用性检验方法等进行了全面的增修订,因此,生产企业仍需针对2015年版药典通用性要求方面对本产品进行相应的评估。 3.问:关于药品执行标准的表述方式的问题。 答:对于注册标准不低于《中国药典》项目的制品,执行注册标准,其执行标准表示方式为:“执行药品注册标准且符合《中国药典》2015年版要求”。 4.问:对于进口药品生产企业,能否使用注册代理公司出具的说明信来代替国外的声明信,进行备案或补充申请的申报?
答:原则上注册代理公司应出具持证商的声明信。如使用说明信代替国外的声明信,应同时提供进口药品生产企业出具的委托注册代理公司办理该事项的委托书。 5.问:国家食药总局2015年第67号公告中规定,2015年版药典自2015年12月1日起实施“。如何界定产品的执行日期? 答:按是历版药典执行惯例要求,自2015年12月1日起生产或进口的药品应符合2015年版药典的相关规定。 6.问:按照实施公告要求提出备案或补充申请的品种,审评审批期间是否仍可执行原标准,期间若有进口再注册申请的是否可按原注册标准核发新证。 答:申请人应按105号实施公告第五款规定执行。出现补充申请与再注册申请交叉情形者,建议补充申请与进口再注册合并审评,如2015年12月1日起前已提交补充申请,可在补充申请期间执行原标准的要求。 7.问:制剂中间体是否也需要按照制剂的药典标准进行提高? 答:生产企业根据需求,自行对制剂中间体的质量标准进行评估,确保其生产的制剂应符合2015版药典要求。按批准文号管理的制剂中间体必须执行105号公告的要求。
本文从网络收集而来,上传到平台为了帮到更多的人,如果您需要使用本文档,请点击下载,另外祝您生活愉快,工作顺利,万事如意! 史上最全的保健品营销策划全套方案
目录 一、产品概述 二、策略组合 三、模式总结 四、操作工具 一个新产品的上市能否成功,取决于很多因素,但其中最重要的,无疑是上市初期的市场启动方案。 一、产品概述 ****是一种具有治疗乙肝功效的国家珍稀植物,“****乙肝舒康胶囊”即是以****为君药配制而成的中药复方制剂。因此,在产品操作过程中,我们把****乙肝舒康胶囊简称为“****”。 肝药市场营销环境复杂,同类产品众多,开发时间较长,患者心理已趋理性,我们对产品和营销的认识也必须与时俱进,实是求是的顺势而动。在过去的市场操作中,我们突出产品的的一个独特卖点即能打动患者,所以早期的USP观点成为营销界的法宝(USP即uniqespecialpoint,台湾翻译为“独特的销售主张”,我们翻译为“产品的独特卖点”)。但随着消费者对产品的选择自由度越来越大,尤其是肝药市场经过近十年的一遍遍的炒作冲洗,肝病患者越来越难以说服,很多产品单凭一个USP很难担当起说服患者的重任。实践证明,一个产品可以有两到三个中心USP,七到十个辅助USP,以中心卖点作为核心诉求,把其它都作为这些中心卖点的支持点,这样对患者的说服力就得到了最大化的加强,营销效果自然不错。 经各大市场营销实践检验,****具有如下三大中心卖点和9大支持点。 ****中心卖点: (1)、独一无二的“****”核心概念。患者相信****是治疗乙肝的有效药物,自然就相信****乙肝舒康胶囊。****是我们的自属商标,****即等于****乙肝舒康胶囊,“****”概念是统领所有产品卖点的核心USP。 (2)、主流权威媒体对****的反复报道。中央电视台、《人民日报》、《光明日报》、《新华每日电讯》、《健康报》、《中国中医药报》、《中国医药报》、《科技日报》、《人民日报海外版》及泰国《星暹日报》、台湾《中国医药导报》等各大媒体的多次重点报道。 (3)、59%转阴率及其背后强大的学术支持。印度斯亚咖依、美国布林伯格、英国《柳叶刀》、韩国郑泰浩、香港、台湾及学术论著《病毒性肝炎》等权威医学研究证明,****是目前世界公认的对乙肝患者效果最好的药物。
药品广告审查办法》2018 年修订版(全文) 来源:时间: 2018-12-26 16:09:53 药品广告审查办法 【 2007 年 3 月 13 日国家食品药品监督管理局、国家工商行政管理总局令第 27 号发布, 2007 年 5 月 1 日起施行; 2018 年 12 月 21 日国家市场监督管理总局令第 4 号《市场监管总局关于修改〈药品广告审查办法〉等三部规章的决定》修订】 第一条为加强药品广告管理,保证药品广告的真实性和合法性,根据《中华人民共和国广告法》(以下简称《广告法》)、《中华人民共和国药品管理法》(以下简称《药品管理法》)和《中华人民共和国药品管理法实施条例》(以下简称《药品管理法实施条例》)及国家有关广告、药品监督管理的规定,制定本办法。
第二条凡利用各种媒介或者形式发布的广告含有药品名称、药品适应症(功能主治)或者与药品有关的其他内容的,为药品广告,应当按照本办法进行审查。 非处方药仅宣传药品名称(含药品通用名称和药品商品名称)的,或者处方药在指定的医学药学专业刊物上仅宣传药品名称(含药品通用名称和药品商品名称)的,无需审查。 第三条申请审查的药品广告,符合下列法律法规及有关规定的,方可予以通过审查: (一)《广告法》; (二)《药品管理法》; (三)《药品管理法实施条例》; (四)《药品广告审查发布标准》; (五)国家有关广告管理的其他规定。 第四条省、自治区、直辖市药品监督管理部门是药品广告审查机关,负责
本行政区域内药品广告的审查工作。县级以上工商行政管理部门是药品广告的监督管理机关。 第五条国家食品药品监督管理局对药品广告审查机关的药品广告审查工作进行指导和监督,对药品广告审查机关违反本办法的行为,依法予以处理。 第六条药品广告批准文号的申请人必须是具有合法资格的药品生产企业或者药品经营企业。药品经营企业作为申请人的,必须征得药品生产企业的同意。申请人可以委托代办人代办药品广告批准文号的申办事宜。 第七条申请药品广告批准文号,应当向药品生产企业所在地的药品广告审查机关提出。 申请进口药品广告批准文号,应当向进口药品代理机构所在地的药品广告审查机关提出。 第八条申请药品广告批准文号,应当提交《药品广告审查表》(附表1 )、与发布内容相一致的样稿(样片、样带),以及以下真实、合法、有效的证明文件: (一)申请人的《营业执照》复印件;
对照药品(参比制剂)一次性进口公告解读对照药品一次性进口公告有以下特点: 1.公告指出:受理审查及审批权力委托给各省局,极大程度简化了程序,节约时间; 2.公告规定了受理时限5个工作日,审查时限20个工作日。 3.进口药品批件有效期延长至12个月。 4.申报资料不再要求提供对照药品的质量标准和出厂检验报告书, 5.需向预进口口岸食品药品监督管理局进行备案。 进口备案要求 拟进口的对照药品应从《进口药品批件》载明的药品进口口岸进口。进口备案按照以下程序办理: (一)申请人向口岸食品药品监督管理局提出申请办理《进口通关单》,并同时提供以下资料: 1.所进口药品的《进口药品批件》; 2.申请人机构合法登记证明文件复印件(如营业执照、组织机构代码证等)。属于委托申请的,另须提供委托人的合法登记证明文件复印件及委托证明文件; 3.原产地证明复印件; 4.货物合同复印件; 5.装箱单、提运单和货运发票复印件; 6.药品说明书及包装、标签式样(原料药和制剂中间体除外); 7.经其他国家或者地区转口的进口药品,需要同时提交从原产地到各转口地的全部购货合同、装箱单、提运单和货运发票等。 上述各类复印件应当加盖申请人公章。
(二)口岸食品药品监督管理局应按照《药品进口管理办法》的相关规定办理对照药品的进口备案(进口单位取得《药品经营许可证》(生产企业应当取得《药品生产许可证》)和《企业法人营业执照》)。审查工作中,加强对原产地证明文件、购货合同以及发票等文件的审核,确认所进口对照药品的真实产地。 (三)口岸食品药品监督管理局审查全部资料无误后,准予进口备案,发出《进口药品通关单》。 6.明确说明:研究用对照药品的一次性进口申请,可不要求进行口岸检验的规定。 7.临床试验对照品检验规定放宽为申请人可自行检验,也可委托药品检验所进行委托检验。 8.明确规定临床试验对照药品的检验标准选择:(1)生产厂家的质量标准;(2)《中华人民共和国药典》2015年版中收载对的标准;(3)申请人自拟标准,且符合《中华人民共和国药典》2015年版的通用要求。 9.增加了麻醉药品、精神药品、临床试验用生物制品的对照药品不适用本公告的规定。